通常陶氏纳滤膜过滤的含盐量为苦咸水范围的某些井水呈还原态,典型特点是含有二价的铁和锰,有时还会存在硫化氢和氨。如果对陶氏纳滤膜过滤的这类水源进行氯化处理,或当水中含氧量超过5mg/L时,Fe2+将转化成Fe3+,形成难溶性的胶体氢氧化物颗粒。铁和锰的氧化反应如下:
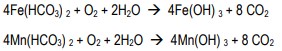
由于铁的氧化在很低的pH值时就会发生,因而陶氏纳滤膜出现铁污染的情况要比锰污染的情况更多,即使SDI小于5,陶氏纳滤膜进水的铁含量低于0.1mg/L,仍会产生铁污染问题。碱度低的进水铁离子含量要高,这是因为FeCO3的溶解度会限制Fe2+的浓度。

处理这类水源的一种方法是防止其在整个陶氏纳滤膜过滤过程中与空气和任何氧化剂如氯的接触。低pH值有利于延缓Fe2+的氧化,当pH<6,氧含量<0.5mg/l时,允许Fe2+浓度不高于4mg/L,另一方法是用空气、Cl2或KMnO4氧化铁和锰,将所形成的氧化物通过介质过滤器除去,但需要注意的是,由硫化氢氧化形成的胶体硫可能难以由过滤器除去。
海绿石就是这样一种粒状过滤介质,当其氧化能力耗尽时,它可通过KMnO4的氧化来再生,再生后将残留的KMnO4完全冲洗掉,以防止对陶氏纳滤膜的氧化破坏。当陶氏纳滤膜的原水中含Fe2+的量小于2mg/L时,可以采用这一处理方法,如原水中含更高的Fe2+时,可在过滤器进水前连续投加KMnO4,但是在这种情况下,需要采取措施例如安装活性炭滤器以保证没有高锰酸钾进入陶氏纳滤膜内。
Birm过滤也可以有效地用于从陶氏纳滤膜系统进水中去除Fe2+,Birm是一种硅酸铝基体上涂有二氧化锰的过滤介质,它对溶解氧和二价铁之间的反应起催化作用,使可溶性二价铁和锰形成沉淀,并且通过滤器反洗可将这些沉淀冲出滤器。由于该过程pH将升高,可能会发生LSI值变化,因而要预防滤器和陶氏纳滤膜系统内出现CaCO3沉淀。
"